O câncer é uma doença genética porque as alterações ocorrem dentro de genes específicos, mas na maioria dos casos não se trata de doença herdada.
Em uma doença hereditária, o defeito genético está presente nos cromossomos de um dos pais (ou em ambos) e é transmitido para o zigoto. Por outro lado, as alterações genéticas que causam a maioria dos canceres originam no DNA das células somáticas durante a vida da pessoa afetada. Por causa dessas alterações genéticas, as células cancerosas se proliferam incontrolavelmente, produzindo tumores malignos que invadem os tecidos saudáveis próximos às células tumorais. Durante o tempo em que o tumor permanece localizado, a doença pode ser tratada com drogas específicas ou curada por remoção cirúrgica do tumor. Entretanto, os tumores malignos tendem a se disseminarem, cujo processo é conhecido por metástase, onde grupos de células cancerosas “escapam” da massa tumoral e atingem a circulação sangüínea ou linfática, e se espalham para outros tecidos e órgãos, criando tumores secundários. A remoção cirúrgica desses tumores metastáticos é extremamente difícil, muitas vezes sem sucesso.
Devido ao seu impacto na saúde e a esperança de que se pode desenvolver meios para a cura dos canceres, muitas pesquisas tem sido desenvolvidas ao longo de décadas. Embora estes estudos tenham resultado em marcante conhecimento das bases celulares e moleculares do câncer, o impacto dos seus benefícios ainda é pequeno, quer na prevenção ou no aumento da sobrevida da maioria dos canceres. Para se ter uma idéia desse processo , foram realizadas pesquisas sobre os principais casos de canceres e suas relações com óbitos, durante todo o ano de 1997 nos Estados Unidos (tabela). Por meio desses dados é possível observar que o tipo mais prevalente de câncer (próstata) é um dos que menos causa a morte, onde a relação caso/óbito é de 7,73. Os canceres mais graves cuja relação caso/óbito é próxima de 1,0 são os que acometem o pâncreas, o cérebro e os pulmões.
Tabela 1: Relação entre casos de canceres diagnosticados em 1997 nos Estados Unidos com o número de óbitos no mesmo período.
|
Tipo de Câncer |
Casos Diagnosticados |
Óbitos |
Relação Caso/Óbito |
| Próstata |
325.000 |
42.000 |
7,73 |
| Mama |
180.000 |
43.000 |
4,18 |
| Pulmão |
165.000 |
160.000 |
1,03 |
| Cólon |
90.000 |
43.000 |
2,09 |
| Linfoma |
60.000 |
20.000 |
3,00 |
| Bexiga |
52.000 |
12.000 |
4,33 |
| Melanoma |
48.000 |
8.000 |
6,00 |
| Reto |
45.000 |
10.000 |
4,50 |
| Rim |
40.000 |
20.000 |
2,00 |
| Leucemia |
40.000 |
35.000 |
1,14 |
| Pâncreas |
40.000 |
40.000 |
1,00 |
| Ovário |
38.000 |
25.000 |
1,52 |
| Cérebro |
28.000 |
27.000 |
1,03 |
Os tratamentos atuais semelhantes à quimioterapia e radiação, necessitam de maior especificidade para matar as células cancerosas sem lesar simultaneamente as células normais. Muitos centros de pesquisas estão atualmente empenhados na busca de terapia mais efetiva contra as células cancerosas e menos agressiva às células normais.
A biologia do câncer
As informações sobre o comportamento das células cancerosas se baseiam em pesquisas de crescimento celular “in vitro”, usando meios de cultura apropriados. Há grandes diferenças entre os crescimentos de células normais e células tumorais. As células normais crescem e se espalham dispostas numa simples camada de células. As células tumorais crescem desordenadamente em agrupamentos. É, portanto, na disposição do crescimento celular que se fundamenta a principal diferença entre as células normais e cancerosas. Por outro lado, a capacidade de crescimento e divisão entre essas células não é muito diferente. Apesar disso, é importante considerar que ao contrário das células normais, as células malignas não respondem aos sinais de regulação para cessar o crescimento e a divisão celular e, assim, se acumulam e transformam-se em tumores.
O FENÓTIPO DE UMA CÉLULA CANCEROSA
Um grande número de diferenças estruturais e bioquímicas foi estabelecido entre células normais e cancerosas. Porém, há diferenças entre as próprias células cancerosas, fato que torna impossível descrever as propriedades típicas dessas células. O comportamento das células cancerosas é mais facilmente estudado quando as mesmas crescem em meios de cultura. As células cancerosas podem ser obtidas por remoção de um tumor maligno, dissociando-as e isolando-as do tecido, e cultivando-as em meios de cultura apropriados. Por outro lado, as células normais podem ser convertidas em células cancerosas por tratamento com substâncias químicas carcinogênicas, radiação e vírus tumorais. Essas células normais que foram transformadas “in vitro” podem causar tumores quando injetadas em animais.
As alterações são principalmente observadas dentro dos cromossomos das células cancerosas, bem como das “células transformadas” em cancerosas. As células normais mantém seus cromossomos diplóides direcionados ao crescimento e divisão celular, tanto “in vivo” quanto “in vitro”. Em contraste, as células cancerosas freqüentemente tem aberrações cromossômicas, uma condição patológica conhecida por aneuploidia. Assim, os cromossomos diplóides de uma célula normal podem sofrer lesões, porém, antes que a célula sofra uma transformação em célula cancerosa, ocorre a ativação de proteínas específicas da célula que causam a sua eliminação, num processo conhecido por apoptose. Entretanto, a célula cancerosa freqüentemente falha na estimulação da apoptose, e dessa forma seus cromossomos se desorganizam com mais intensidade.
As mais notáveis alterações morfológicas que ocorrem no citoplasma de uma célula cancerosa envolve o citoesqueleto. Enquanto uma célula normal contém organizada rede de microtúbulos, microfilamentos, e filamentos intermediários, o citoesqueleto da célula cancerosa é desorganizado e com redução de conteúdos dessas organelas. Muitas mudanças morfológicas também são observadas na superfície da célula, incluindo o aparecimento (ou desaparecimento) de componentes específicos. Algumas células cancerosas possuem novas proteínas de superfícies, conhecidas por antígenos associados a tumores, que induzem a formação de anticorpos específicos contra as células. Porém, quando as ações desses anticorpos se tornam insuficientes, as células cancerosas crescem em número e se tornam tumorais. Essas mudanças nas superfícies das células cancerosas alteram-lhes a adesividade para com outras células teciduais bem como com substratos não celulares (proteínas de adesão). Assim, a perda da adesividade permite que as células cancerosas se destacam da massa tumoral e migram para outros tecidos e órgãos do corpo, cujo processo é conhecido por metástase.
Outras alterações importantes observadas em meio de cultura são as seguintes:
a) locomoção: as células normais deixam de se locomover quando se tornam cercadas pelas células vizinhas; as células cancerosas ignoram os sinais emitidos pelas células vizinhas e continuam suas atividades de locomoção;
b) fator de crescimento: as células normais dependem de fatores de crescimento presente no soro humano adicionado ao meio de cultura; as células cancerosas proliferam na ausência do soro pois o ciclo celular não depende dos sinais transmitidos pelos fatores de crescimento aos receptores de superfície;
c) capacidade de divisão celular: as células normais tem capacidade limitada para divisão, após um número finito de divisões mitóticas elas sofrem o processo de decodificação que a impede de crescer e dividir; as células cancerosas são “imortais” pois se dividem indefinidamente, devido à presença de telomerase nessa célula.
CAUSAS DE CÂNCER
A primeira observação de câncer relacionado com agentes ambientais foi feita em 1775 por Percival Pott, um médico inglês, em limpadores de chaminés que apresentavam altas prevalências de câncer na cavidade nasal e na pele do saco escrotal devido à fuligem. Posteriormente, com o desenvolvimento científico obteve-se o isolamento químico dos vários componentes da fuligem, que, ao serem aplicados em animais de laboratórios, mostraram ser carcinogênicos. Atualmente se sabe que há muitas substâncias químicas potencialmente carcinogênicas, além de radiações ionizantes e uma variedade de vírus capazes de estimular o desenvolvimento de câncer. Todos esses componentes tem propriedades comuns que alteram o genoma.
As principais substâncias químicas carcinogênicas, semelhantes àquelas da fuligem ou da fumaça do cigarro, podem ser diretamente mutagênica, ou convertida em componentes mutagênicos por enzimas celulares. Da mesma forma, as radiações ultravioletas, que são as principais causas de câncer de pele, são também muito mutagênicas.
Determinados tipos de vírus podem infectar células de vertebrados, transformando-as em células cancerosas. Esses vírus estão divididos em dois grandes grupos: vírus – DNA – tumorais e vírus – RNA – tumorais, cuja classificação se deve ao tipo de ácido nucléico encontrado no vírus. Entre os vírus com DNA capazes de transformar células normais em cancerosas estão os seguintes: polioma vírus, simian vírus 40 (SV40), adenovirus e vírus herpético.
Os vírus com material genético de ácido ribonucléico ou vírus – RNA, têm estruturas similares ao vírus HIV, e aqueles capazes de causarem câncer estão sempre relacionados a doenças primárias, conforme mostra a tabela abaixo.
| Doença primária do vírus | Câncer relacionado |
| Vírus da hepatite B | Câncer hepático |
| Papiloma vírus | Câncer cervical |
| Vírus Epstein-Barr | Linfoma de Burkitt |
| Vírus Herpético | Sarcoma de Kaposi |
| Sarcoma de Kaposi | Leucemia Linfocítica T |
Os vírus tumorais (DNA ou RNA) podem transformar as células infectadas em células cancerosas devido à liberação de proteínas virais que interferem nas atividades de regulação celular relacionadas ao crescimento das células.
Estudos epidemiológicos também mostram a intensa relação entre meio-ambiente e hábitos das pessoas com câncer. Assim, a poluição ambiental, o tipo de trabalho, em especial ambientes quimicamente poluídos, e o efeito cumulativo dos compostos e sub-compostos químicos, estão relacionados como principais causas de câncer. Há o consenso geral entre os epidemiologistas que alguns ingredientes na dieta, p. ex. gordura animal e álcool, podem aumentar o risco de desenvolvimento de câncer, enquanto que certos componentes de frutas e vegetais podem reduzir o risco de câncer.
A relação entre composto químico e origem de câncer está bem exemplificada pela aflotoxina B, uma proteína tóxica encontrada em nozes e amendoins, responsável por alta incidência de câncer hepático em populações asiáticas que consomem este tipo de alimento. O componente químico da aflatoxina B causa a substituição da base nitrogenada guanina por timina (G®T) no códon 249 que faz parte do gene supressor de tumor p53, conforme mostra a figura 1 abaixo.
|
245 |
246 |
247 |
248 |
249 |
250 |
251 |
|
|
||||||
|
GCC |
ATG |
AAG |
CGC |
AGG |
CCC |
ATC |
Figura 1: Esquema de genes no cromossomo e parte da sequência de bases nitrogenadas que participam da estrutura do gene supressor de tumor (gene p53).
Com essa substituição, a atividade do gene supressor em inibir o oncogene (que causa lesões hepáticas) fica prejudicada. Assim, o oncogene fica “livre” para desenvolver o câncer hepático.
GENÉTICA DO CÂNCER�
O câncer é uma das duas causas mais comuns de morte em países ocidentais, afetando aproximadamente um entre cada três indivíduos. Conclui-se, portanto, que o câncer é uma doença muito comum. Porém, no nível celular, o desenvolvimento do câncer é um evento raro. Sempre que as células de um tumor canceroso são examinadas geneticamente, invariavelmente mostram-se originadas de uma simples célula. Assim, diferentemente de outras doenças que requerem um grande número de células modificadas, o câncer é resultante de proliferação descontrolada de uma simples linhagem celular. Desta forma, considerando que o corpo humano contém trilhões de células, bilhões das quais se dividem em determinados dias, é possível que qualquer uma delas pode mudar sua composição genética e gerar células tumorais.
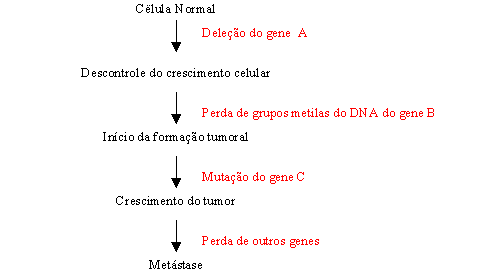
Uma das principais razões que um grande número de células não se transforma em tumores cancerosos é que a transformação maligna requer mais que uma simples alteração genética. O desenvolvimento de um tumor maligno (tumorigenese) é um processo de muitas etapas caracterizado por uma progressão de alterações genéticas em uma simples linhagem celular, tornando-a incapaz de se controlar. Após a célula ter-se tornado cancerosa, ela continua a acumular mutações, alterando-lhe suas propriedades e fazendo-a mais agressiva, conforme mostra a figura 2 a seguir:
Figura 2: Sequência de eventos que participam na transformação de células normais em cancerosas.
Como é possível observar pela análise global da figura acima apresentada, a instabilidade genética que afeta determinados tipos de canceres é uma das principais causas que dificulta o tratamento convencional da quimioterapia. Acredita-se que essa dificuldade se deve ao fato das células cancerosas formarem massas celulares dentro do tumor que são resistentes à droga.
Em geral os eventos que transformam células normais em células tumorais são caracterizados por: a) progressão da célula através do ciclo celular (aumento do crescimento de células no tecido); b) adesão das células às suas vizinhas; c) apoptose e d) restauração do DNA lesado, podem permanecer num “estado de latência” (ou dormência), durante toda uma vida.
Há também que considerar as influências não genéticas na tumorigênese, geralmente de origem química ou física. Essas influências podem atuar de duas formas numa célula e denominadas por iniciação e promoção. A iniciação ocorre quando uma substância mutagênica induz a formação de tumor. A promoção é quando o agente induz o tumor tornar-se maligno.
A IMPLICAÇÃO GENÉTICA NO CÂNCER
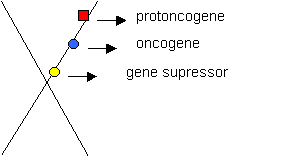
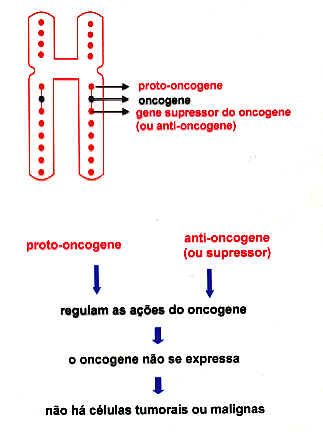
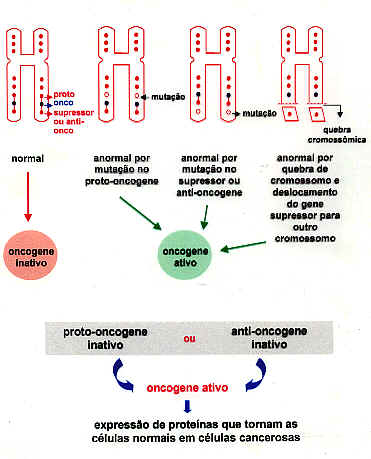
Os genes que estão implicados na carcinogênese estão divididos em duas grandes categorias: genes supressores de tumores (GST) e oncogenes. Os GST atuam como freios de células, ou sejam, codificam proteínas que restringem o crescimento de células e as previne de se tornarem malígnas. Pesquisas realizadas recentemente mostraram que portadores de alguns tipos de câncer tinham células com cromossomos deletados nas regiões desses genes, e dessa forma os GST não eram ativos. Os oncogenes codificam proteínas que promovem a perda do controle de crescimento das células, fato que pode torna-la malígna. Assim, os oncogenes atuam como aceleradores da proliferação celular e da tumorigenesis. A existência dos oncogenes se deu devido às investigações de RNA viral capazes de causarem tumores. Demonstrou-se que esses virus transformam células normais em células tumorais, pois carregam um gene que codifica uma proteína que interfere nas atividades normais da célula. Durante as pesquisas realizadas que culminaram com a descoberta dos oncogenes, observou-se que as células tinham também uma variedade de genes que as protegiam contra a “liberação” dos oncogenes, e denominados por proto-oncogenes (figura 3). Apesar dos proto-oncogenes codificarem proteínas com várias atividades funcionais que atuam na fisiologia normal das células, eles podem ser ativados por vários mecanismos biológicos no sentido de se converterem em oncogenes. Essas “ativações” podem decorrer de mutações que alteram as propriedades e as expressões dos proto-oncogenes, bem como por quebra cromossomica (figura 4). Assim, qualquer uma dessas alterações genéticas pode levar uma célula a ter o seu controle de crescimento afetado, tornando-a malígna. As tabelas 2 e 3 mostram alguns genes supressores de tumores (GST) e proto-oncogenes como causadores de câncer.
Tabela 2: Genes supressores de tumores GST relacionados como causas de câncer e síndromes herdadas.
| GST | Tumor Primário | Síndrome Herdada |
| APC | Colo-retal | Polipose adenomatosa familiar |
| BRCA-1 | Mama | Câncer de mama familiar |
| NF-1 | Neurofibroma | Neurofibromatose tipo-1 |
| NF-2 | Meningiomas | Neurofibromatose tipo-2 |
| p16 (MTS1) | Melanoma | Melanoma familiar |
| p53 | Sarcomas, linfomas, etc | Síndrome Li-Fraumeni |
Tabela 3: Relação entre proto-oncogene, tipo de lesão e tipo de câncer.
| Proto-oncogene | Lesão no proto-oncogene | Neoplasia |
| Abl | Translocação | Leucemia mielóide crônica |
| bcl-2 | Translocação | Linfoma de células-B |
| CYCD-1 | Translocação | Ca de mama |
| Myc | Translocação | Linfoma de Burkitt |
| gip | Mutação de ponto | Ca de ovário e glândula adrenal |
| K-ras | Mutação de ponto | Leucemias agudas, Ca de tireóide e melanoma |
| myc | Amplificação | Ca de pulmão, mama e cervix |
| L-myc | Amplificação | Ca de pulmão |
| N-myc | Amplificação | Neuroblastoma |
REFERÊNCIAS BIBLIOGRÁFICAS
Pui CH, Behm FG, Christ WM: Clinical and biologic relevance of immunologia marker
Studies in childhood acute lymphoblastic leukemia. Blood 82:323, 1993.
Karp G: Cell and Molecular Biology, 2nd ed., John Wiley & Sons, Inc. New York, 1999.
Sandenberg A: The chromosomes in human leukemia. Semin Hemat 23: 301, 1996.
Stiene-Martin EA, Steininger CAL, Koepke JÁ: Clinical Hematology, 2nd ed, Lippincott, New York, 1998.